您好,欢迎访问陕西省中医药研究院陕西省中医医院官方网站!
(一)立项流程
1.意向沟通:申办方/CRO 与机构及专业组同步沟通,确定承接意向。
2.资料初审:按照药物临床试验立项资料清单/医疗器械临床试验立项清单递交电子版资料至机构邮箱 sxzyjgb@126.com,机构办5个工作日反馈初审意见(立项申请表请前往下载中心下载)。
3.资料递交:参照审核意见修改后递交一套完整版纸质资料至机构办公室。资料递交要求 ,正反面打印,加盖封面及骑缝章。 资料整理:统一使用黑色快牢夹文件夹装订并制作侧签,文件顺序按照递交资料目录整理,侧签模板见附件立项资料清单。
4.召开立项会:接收纸质立项资料后机构办公室及时组织立项审核会。
(二)伦理审查
伦理委员会办公室秘书:史亮
联系电话:15202961099
伦理办联系电话:029-87251691
伦理邮箱: sxszyyyllb@126.com
通讯地址:陕西省中医医院伦理委员会办公室
(二)遗传流程
1. 不涉及遗传办:提供声明并加盖公司公章(见附件);
2. 涉及遗传办:请参照准备以下资料;
2.1递交信
2.2临床试验人类遗传资源申请表;
2.3 人类遗传资源审批申请书、受理单及审批决定书等;
2.4 备案信息表、国家卫生健康委员会政务服务平台备案成功的截图打印加盖公章;
2.5 国际合作协议文本(如涉及,应提供);
2.6 需要本单位盖章的合作单位签章/承诺书;
2.7 法律法规要求的其他材料;
2.8机构办在7个工作日内协调签署承诺书盖章,通知申办方/CRO来院领取纸质文件。
(三)合同流程
1.1 拟定时间:在等待伦理委员会批复文件的同时可以起草合同;
1.2 模板要求:机构合同模板请联系机构秘书获取,可接受申办方/CRO模板;
1.3 合同内容:使用申办方/CRO模板,必须包含以下关于申办方/CRO 的8条职责内容:
遵循国家临床试验的相关法律法规;
监控研究质量和安全;
确保研究方法和过程符合伦理道德规范;
使用经过培训且具备资质的研究团队;
建立质量保障体系,确保研究结果和报告在统计上准确无误,合乎
伦理且没有偏移;
建立质量保障体系确保研究数据的准确性和完整性;
建立质量保障体系保护研究受试者数据的隐私和保密性;
确保针对患者或研究人员的激励措施不会损害研究的可靠性。
1.4 费用明细:
研究者观察费:与机构、PI 协商确定;
机构管理费:研究者观察费30%;
机构立项费:2000元;
资料保管费:自结题之日起5年内免费;5年后按照2000元/年标准收费;
药品/器械管理费:2000元;
检验检查费:按照方案要求据实核算,检查费用清单的项目请联系专业科室收集/机构办收集;
挂号费:按实际发生结算;
受试者补助:按照知情同意书中补助金额核算(由申办方/CRO支付);
税费:目前1.5%,后期随国家政策调整,如实缴纳;
筛败受试者:应支付相应筛选期研究者观察费;
脱落、剔除受试者:应按照实际随访周期支付研究者观察费;
各项费用最后均按照协议据实结算。
1.5 付款节点:
首付款:项目启动前支付并提供支付凭证,首付款应不低于协议款总额的30%;
中期款:支付节点、比例可根据项目合同具体协商;
尾 款:支付协议款剩余部分,在分中心小结盖章前完成支付。
申办方/CRO与机构办秘书、PI沟通协议细节,起草合同,将合同初稿后发送至机构邮箱(sxzyjgb@126.com),由PI、机构办主任/副主任初审后,提交OA进行审批,经各方沟通后确认的合同由申办方/CRO、PI签署后交回机构,由机构主任/副主任签署,盖章后正式生效。
3.1 主合同签署:申办方/CRO→PI→机构;
3.2 CRC协议:申办方/CRO→SMO→机构;
3.3 签署时限:一般5—10个工作日内签署;
3.4 合同份数:机构办需存留合同原件共计3份(机构2份、党政办公室1份)。
4.1 发票类型:增值税专用发票/增值税普通发票;
4.2 开票内容:研发和技术服务*临床试验费;
4.3 开票流程:付款成功后,并将转账凭证、项目合同发给机构办秘书,在办理发票开具。
5.账户信息
账户名称:陕西省中医医院
纳税人识别号:12610000732672371N
开户行:交通银行西安西五路支行
银行账户:611301014018010013387
地址:西安市莲湖区西华门4号
联系电话:02987286951
(五)启动流程
1.CDE网站登记:本项目及本中心已在CDE网站进行登记;
2.人遗审批/备案:具体流程参照“遗传办流程”进行;
3.合同签署:具体流程参照“ 合同审核”及“ 合同签署”进行;
4.已完成申办方所在省、直辖市药品监督管理局备案(器械);
5.试验用药品接收:请CRA 先进行药品管理员培训,并按方案要求进行药品接收,留存相关文件;
6.CRC资料信息在机构办备案和考核,并对CRC进行院内相关流程培训;
7.项目章制作:项目章内容:药品/器械名称,刻制内容为药品名称,尺寸为1cm×4cm方章,类别为蓝色油章;
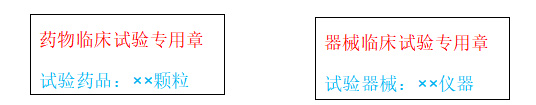
8.试验处方设计:请根据模板设计试验用处方,可根据项目需求调整处方;
9.启动会培训要求:监查员将PPT发至机构秘书。培训内容应当详细、全面、具有实操性,其中药品管理系统、EDC系统、随机系统等重要环节培训应具体到实施者进行针对性培训;
10.启动会流程确认:与专业科室PI、机构办公室秘书确定会议时间与流程;
11.启动准备:CRA准备启动会所需各类表格;
12.向机构提交临床试验项目启动前信息确认表。
(六)质控流程
1.科室一级质控
专业组设定1-2名名人员作为科室质控员,主要职责是对专业组承担的临床试验项目质量进行系统性检查,防止并及时纠正质量偏差。
2.机构二级质控
2.1 项目启动:机构质控员参加临床试验项目启动会,详细了解专业组分工情况,当完成首例入组时,CRA需对项目进行监查,在监查完成后联系机构质控员进行首例质控;
2.2 试验进行中:CRC需要根据项目进展情况,提前联系机构质控员。机构质控员分别于入组30%、50%、80%、最后一例出组、结题重要节点实施逐例质控;
2.3 试验结束:专业组按照临床试验方案完成所有工作后,按照相关中心流程要求将该项目所有资料送至机构办,机构质控员进行结题质控;
2.4 注意事项:①科室质控员需要对临床试验项目进行全程质量控制,在整个项目进行过程中至少完成3次系统性质控并向机构办提交《药物临床试验科室一级质控反馈表》;②机构质控员将质控过程中发现的问题记录于机构二级质控记录表,于检查完成后的3个工作日内由CRC反馈给主要研究者,主要研究者接到后5个工作日内完成整改反馈报告并交至机构质控员,机构质控员视整改情况进行复查;③机构结题质控前申办方和专业组先质控,若申办方有组织稽查需要向机构办提交相关资料(稽查委托函、稽查员简历及GCP证书),稽查结束后需要邀请机构工作人员参加稽查沟通会;④机构质控合格的项目方可锁定数据库并进行数据统计分析,待分中心小结表及总结报告完成后应及时递交机构办进行审核。
(七)结题流程
1.申办方监查/第三方稽查;
2.科室质控,科室项目质控员负责对试验项目进行结题前质控,并对发现的问题进行整改;
3.机构质控员对项目进行结题前二级质控。并将质控发现的问题反馈给研究者,研究者组织人员进行整改,待整改完善后,机构质控员确认问题已全部整改;
4.完成试验费用最终核算,付清尾款。项目涉及检查费用核算参照机构办模板;其他费用按照协议规定计算;
5.试验用药品/器械、物资等清点回收;
6.分中心小结报告表机构质控员审核,机构办公室主任/副主任签字盖章;
7.伦理进行结题审查;
8.向机构办公室递交《临床试验相关中心函》;
9.关闭中心:所有人员签署完成《临床试验结题签认表》;
10.纸质版资料存档:按照归档目录,提前一周预约归档将整理好的资料移交至机构办进行归档质控;
11.所有人员签署完成《临床试验结题签认表》,并将整理好的资料移交至机构办,审核无误后统一归档;
12.组长单位总结报告完成后递交机构、伦理备案。
 备案号:陕ICP备17003884号-1
备案号:陕ICP备17003884号-1 电话:029-87213310 【全年咨询时间】08:00-12:00;14:00-17:30
电话:029-87213310 【全年咨询时间】08:00-12:00;14:00-17:30 Copyright © 版权所有:All Rights Reserved 陕西省中医医院
Copyright © 版权所有:All Rights Reserved 陕西省中医医院
陕西省中医医院

陕西省中医药研究院